
O Grupo Operacional QUALIMILHO é uma parceria da ANPROMIS e da AGROMAIS com o Instituto Nacional de Investigação Agrária (INIAV), o Instituto de Soldadura e Qualidade (ISQ) e cinco agricultores da região da Golegã, com o propósito de identificar os fungos potencialmente produtores de micotoxinas, desenvolver soluções que limitem a presença desses fungos e, em paralelo, implementar um sistema de monitorização de temperatura e teor de humidade, em todas as fases da cadeia de produção do milho.
As micotoxinas são metabolitos secundários tóxicos produzidos por fungos que pertencem na sua maioria aos géneros Aspergillus, Penicillium e Fusarium.
Segundo a FAO, 25% da produção mundial de commodities agrícolas estão contaminadas com micotoxinas. A presença das micotoxinas é um problema de grande complexidade e gravidade à escala global e que afeta toda a cadeia de valor do milho, pela elevada probabilidade de ocorrência e pelo efeito direto sobre a segurança dos alimentos.
Para que exista contaminação por micotoxinas é indispensável a contaminação fúngica prévia, que ocorre no campo e também após a colheita, principalmente durante o armazenamento do milho. Devido às condições propícias e específicas para o desenvolvimento das diferentes espécies de fungos produtoras de micotoxinas, as fumonisinas, zearalenona (ZEA) e desoxinivalenol (DON) surgem principalmente no campo e as aflatoxinas e a ocratoxina A (OTA) durante o armazenamento (ver Tabela 1).
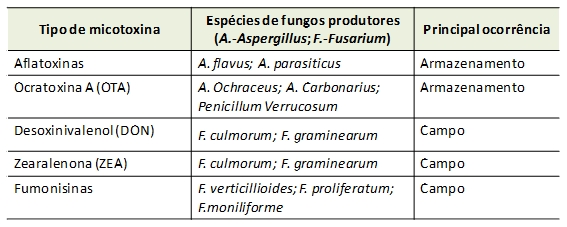
Tabela 1: Tipos de micotoxinas mais frequentes no milho, espécies de fungos produtores e sua principal ocorrência.
A estratégia de prevenção e redução das micotoxinas é complexa e o plano de ação do QUALIMILHO envolve atividades aplicadas no campo e após a colheita do milho (ver Figura 1).
A utilização de boas práticas de gestão no campo, nomeadamente a escolha adequada da cultura precedente, o conveniente tratamento dos resíduos, a redução dos fungos patogénicos no solo, a escolha da variedade de acordo com as classes de risco, a proteção da cultura ao ataque de insetos e a antecipação da colheita são possíveis ações para reduzir os desafios associados às contaminação do milho por micotoxinas.
Após a colheita, as ocorrências de micotoxinas dependem das condições de humidade e temperatura, daí que, deve evitar-se a pré-armazenagem de grão húmido e a secagem deve ser conduzida de modo a não danificar a estrutura do grão. As condições de temperatura, ventilação e duração da secagem são fatores muito relevantes para a qualidade porque os grãos partidos ficam mais vulneráveis ao ataque de insetos que são vetores de fungos produtores de micotoxinas. O grão deve ser convenientemente limpo antes de armazenado e durante o armazenamento é essencial controlar a temperatura e humidade, e a circulação do grão poderá vir a ser necessária para garantir a estabilidade sanitária.
Entre 2017 e 2021 as atividades desenvolvidas pelo QUALIMILHO compreenderam várias fases: desde a implementação e validação de metodologias para quantificação das micotoxinas, a caraterização da colheita e pré-colheita, o controle e mitigação, até ao desenvolvimento de um sistema de apoio à decisão para garantir a qualidade e segurança na fileira do milho nacional.
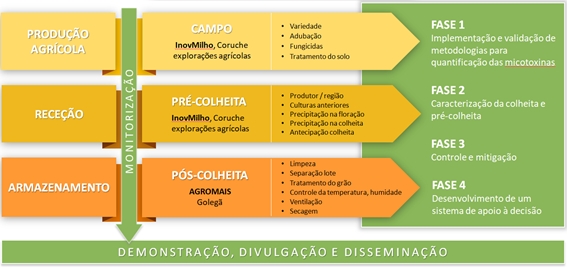
Figura 1: Plano de ação do grupo operacional QUALIMILHO
De acordo com o Regulamento (CE) nº 1881/2006 consolidado com nº 1126/2007, o milho para ser classificado para a alimentação humana tem como limites máximos de 4000 µg/kg para as fumonisinas, 1750 µg/kg para DON, 5 µg/kg para aflatoxina B1, 10 µg/kg para aflatoxinas totais, 5 µg/kg para OTA e 350 µg/kg para ZEA.
A análise das micotoxinas é muito sensível, a maioria dos métodos contempla etapas de preparação da amostra em que a matriz complexa é homogeneizada e as micotoxinas são solubilizadas. Para a quantificação das micotoxinas existem métodos de referência que são sistemas cromatográficos de elevada resolução com diferentes tipos de deteção acoplados a detetor de massa (LC-MS/MS).
No âmbito do QUALIMILHO, o INIAV implementou e validou o método de referência por cromatografia líquida de elevada resolução, acoplada a detetor de massa com analisador por tempo de voo (UHPLC-ToF-MS) para quantificar em simultâneo as aflatoxinas B1, B2, G1, G2, OTA, T2, ZEA e fumonisinas B1 (FB1) e B2 (FB2). Paralelamente, implementou também um outro método rápido, de rastreio por imunoensaio com limites de deteção inferiores ao UHPLC-ToF-MS mas que foi validado satisfatoriamente para despiste de amostras positivas para as fumonisinas totais (B1+B2), OTA, Aflatoxinas (G1+G2), DON, T2, Aflatoxina B1 e ZEA. Este método de rastreio quantifica as fumonisinas totais, contudo, não permite a discriminação das FB1 e FB2.
A distribuição das micotoxinas nos grãos de milho é muito heterogénea, as concentrações estipuladas para os limites máximos são muito baixas, expressos em partes por bilião (ppb ou µg/kg). Uma amostra correspondente a uma única espiga contaminada atinge valores muito superiores aos limites máximos estipulados na legislação (ver Figura 2). Portanto, para que se possa controlar e garantir a precisão e a reprodutibilidade dos resultados analíticos, importa também implementar um plano de amostragem representativo e eficaz.

Figura 2: Espigas de milho que revelam sintomatologia de contaminação com Fusarium e cuja totalidade do grão moído e homogeneizado conduziu a amostras com totais de fumonisinas >4000 µg/kg.
O plano de amostragem adotado pelo QUALIMILHO considerou a retirada aleatória de várias porções incrementais de grão que foram misturados, por forma a obter uma amostra agregada ou global de, pelo menos, 5 kg que foi homogeneizado por trituração. A homogeneização por trituração significa que toda a amostra global foi moída e a farinha passou por um crivo de 1 mm. Depois da moenda, o moinho foi limpo para evitar contaminações cruzadas. As análises das micotoxinas realizaram-se em três porções (repetições) de 50g retiradas aleatoriamente da farinha completamente homogeneizada.
Nas colheitas de 2018, 2019 e 2020 e num conjunto significativo de amostras representativas das explorações do Vale do Tejo, foram realizadas análises para despistar todas as micotoxinas validadas. Em todas as amostras analisadas, apenas foram detetadas fumonisinas em níveis variáveis e abaixo dos limites legais, sendo a FB1 a micotoxina predominante.
Na colheita de 2019 e em oito ensaios com diferentes tratamentos realizados em três explorações do Vale do Tejo, as micotoxinas foram monitorizadas numa amostragem de 25 espigas recolhidas diretamente no campo e em três períodos que antecederam a colheita. As espigas foram recolhidas na maturidade fisiológica, dez e 20 dias após a primeira colheita e os valores mais altos de fumonisinas (>1000 µg/kg) foram obtidos nas 2ª e 3ª datas para o ensaio que não foi tratado (ver Figura 3). O grão proveniente do ensaio em que foi aplicado azoto foi aquele que revelou os valores mais baixos de fumonisinas. Os maiores níveis de fumonisinas foram obtidos no grão proveniente da 3ª data e esses resultados evidenciam que há um maior risco de contaminação em colheitas tardias.
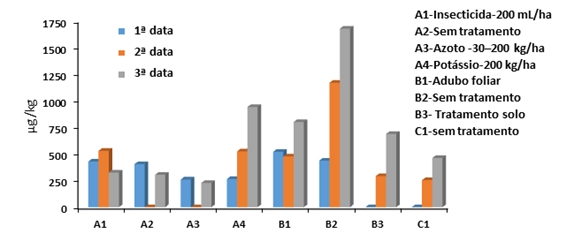
Figura 3: Total de fumonisinas (FB1+FB2) no milho recolhido em oito ensaios conduzidos em explorações da região do Vale do Tejo (A, B, C) recolhidas na maturidade fisiológica (1ª data), após dez dias (2ª data) a após 20 dias (3ª data)
As fumonisinas foram identificadas como sendo as micotoxinas com origem no campo mais relevantes no milho recolhido nas explorações do Vale do Tejo e esses resultados orientaram o plano de ação para a caraterização das diferentes espécies de Fusarium.
Outra atividade do QUALIMILHO foi a avaliação da evolução do grão armazenado, tanto ao nível das espécies de Fusarium presentes como da quantificação das micotoxinas. As avaliações realizaram-se durante seis meses de armazenamento do grão em barricas monitorizadas com sondas de temperatura, humidade relativa e CO2. O Fusarium verticillioides foi a espécie predominante em três períodos de monitorização, foram identificadas apenas fumonisinas com maior incidência da FB1 (4:1). Os níveis de fumonisinas aumentaram durante o período de armazenamento em cerca de 20 a 40% (ver Figura 4). A par do aumento de fumonisinas também aumentaram os valores de humidade relativa, temperatura e CO2 monitorizados.
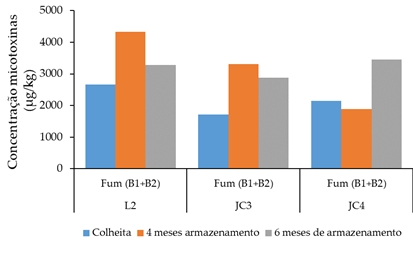
Figura 4: Total de fumonisinas no milho proveniente de três ensaios e de duas explorações do Vale do Tejo determinadas na altura da colheita, após quatro e seis meses de armazenamento em barricas

Equipa participante
Trabalhos publicados
Brites C, Sanches Silva A, Freitas A, Barbosa J (2019). Micotoxinas no milho e seu controle. Vida Rural nº 1848, 34-36.
Carbas B, Soares A, Freitas A, Silva AS, Pinto T, Andrade E, Brites C. Mycotoxin Incidence in Pre-Harvest Maize Grains. Proceedings. 2021; 70(1):24. https://doi.org/10.3390/foods_2020-07667
Carbas B, Simões D, Soares A, Freitas A, Ferreira B, Carvalho ARF, Silva AS, Pinto T, Diogo E, Andrade E, Brites C. Occurrence of Fusarium spp. in Maize Grain Harvested in Portugal and Accumulation of Related Mycotoxins during Storage. Foods. 2021; 10(2):375. https://doi.org/10.3390/foods10020375
Freitas A, Barros S, Brites C, Barbosa J, Silva AS (2019). Validation of a Biochip Chemiluminescent Immunoassay for Multi-Mycotoxins Screening in Maize (Zea mays L.). Food Analytical Methods. https://doi.org/10.1007/s12161-019-01625-1
Silva AS, Brites C, Vila Pouca A, Barbosa J, Freitas A (2019). UHPLC-ToF-MS method for determination of multi-mycotoxins in maize: Development and validation. Current Research in Food Science 1:1-7. https://doi.org/10.1016/j.crfs.2019.07.001
Silva AS, Freitas A, Soares A, Pinto T, Barbosa J, Brites C (2019). New insights for mycotoxin mitigation in the maize chain. 1º Simpósio INIAV para Segurança Alimentar, Vila do Conde, 28 Nov 2019.
Simões D, Andrade E, Brites C, Diogo E (2019). Detection of Fusarium species producers of fumonisins in maize grains in Portugal. 18th Congress of European Mycologists, Varsóvia, Polónia, 16-21 de Set 2019.

